EDTA
Bu madde, Vikipedi biçem el kitabına uygun değildir. (Ocak 2010) |
| |
| Adlandırmalar | |
|---|---|
2,2′,2′′,2′′′-(Ethane-1,2-diyldinitrilo)tetraacetic acid[1] | |
Diğer adlar
| |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| Kısaltmalar | EDTA, H4EDTA |
| 1716295 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.409 |
| EC Numarası |
|
| 144943 | |
| KEGG | |
| MeSH | Edetic+Acid |
PubChem CID
|
|
| RTECS numarası |
|
| UNII |
|
| UN numarası | 3077 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| Özellikler | |
| Kimyasal formül | C10H16N2O8 |
| Molekül kütlesi | 292,24 g mol−1 |
| Görünüm | Renksiz kristaller |
| Yoğunluk | 0,860 g cm−3 (20 °C'de) |
| log P | −0,836 |
| Asitlik (pKa) | 2,0 ; 2,7 ; 6,16 ; 10,26[2] |
| Termokimya | |
Standart formasyon entalpisi (ΔfH⦵298)
|
−1765,4 ila −1758,0 kJ mol−1 |
Standart yanma entalpisi (ΔcH⦵298)
|
−4461,7 ila −4454,5 kJ mol−1 |
| Farmakoloji | |
| S01XA05 (DSÖ) V03AB03 (DSÖ) (salt) | |
| |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | WARNING |
| Tehlike ifadeleri | H319 |
| Önlem ifadeleri | P305+P351+P338 |
| NFPA 704 (yangın karosu) |
|
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
1000 mg/kg (oral, fare)[3] |
| Benzeyen bileşikler | |
Benzeyen alkanoik asitler
|
|
Benzeyen bileşikler
|
|
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |

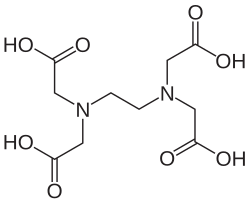
EDTA, Etilendiamintetraasetik asit'in kısaltmasıdır. EDTA polyaminokarboksilik asit bileşiğidir. Genel formülü; [CH2N(CH2COOH)2]2 şeklindedir.
Tarihi
[değiştir | kaynağı değiştir]EDTA ilk olarak Ferdinand Munz tarafından tanımlanmıştır. Munz, EDTA'nın keşfini etilendiamin ve klorasetik asit çözeltilerinden elde etmiştir.
H2NCH2CH2NH2 + 4 CH2O + 4 NaCN + 4 H2O → (NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 NH3
(NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 HCl → (HO2CCH2)2NCH2CH2N(CH2CO2H)2 + 4 NaCl
Poliamino karboksilik asit grubundan olan EDTA'nın kimyasal yapısında 2 amino 4 karboksil ligandı vardır. EDTA metal iyonlarına karşı yüksek çekim gösterir.
[Fe(H2O)6]3+ + H4EDTA [Fe(EDTA)]−+ 6 H2O + 4 H+ (Keq = 1025.1)
EDTA’nın Laboratuvarda Kullanımı
[değiştir | kaynağı değiştir]EDTA laboratuvarda metal iyonlarını tutmak için kullanılır. Biyokimya ve moleküler biyoloji iyon tüketici olarak enzimlere karşı kullanılır. Analitik kimya da kompleksometrik titrasyon, Su sertliği maskeleyici ajanlar analizelerinde kullanılır.
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ss. 79, 123, 586, 754. ISBN 978-0-85404-182-4.
- ^ Raaflaub, Jürg (1956). "Applications of Metal Buffers and Metal Indicators in Biochemistry". Methods of Biochemical Analysis. 3. ss. 301-325. doi:10.1002/9780470110195.ch10. ISBN 978-0-470-30492-1. PMID 13369167.
- ^ Substance Name: Sodium calcium edetate. NIH.gov


