Adalimumab
Bu madde, Vikipedi biçem el kitabına uygun değildir. (Ekim 2017) |
 | |
| Monoklonal antikor | |
|---|---|
| Tür | Tüm antikor |
| Kaynak | İnsan |
| Hedef | TNF alpha |
| Klinik verisi | |
| Ticari adlar | Humira |
| Diğer adlar | D2E7 |
| Biyobenzerler | adalimumab-aacf,[1] adalimumab-aaty,[2] adalimumab-adaz,[3] adalimumab-adbm,[4] adalimumab-afzb,[5] adalimumab-aqvh,[6] adalimumab-atto,[7] adalimumab-bwwd,[8] adalimumab-fkjp,[9] adalimumab-ryvk,[10] Abrilada,[11] Amgevita,[12] Amsparity,[13] Ardalicip,[14] Cadalimab,[15] Ciptunec,[14] Cyltezo,[16] Exemptia,[17] Hadlima,[8] Halimatoz,[18] Hefiya,[19] Hukyndra,[20] Hulio,[21] Hyrimoz,[22] Idacio,[23] Imraldi,[24] Kromeya,[25] Libmyris,[26] Mabura, Simlandi,[27][10] Solymbic,[28] Trudexa,[29] Yuflyma,[2][30] Yusimry[6] |
| AHFS/Drugs.com | Monografi |
| MedlinePlus | a603010 |
| Lisans veri |
|
| Gebelik kategorisi | |
| Uygulama yolu | Derialtı |
| İlaç sınıfı | TNF inhibitörü |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Farmakokinetik veri | |
| Biyoyararlanım | %64 (derialtı), %0 (ağızdan) |
| Eliminasyon yarı ömrü | 10–20 gün |
| Tanımlayıcılar | |
| CAS Numarası | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| ECHA Bilgi Kartı | 100.224.376 |
| Kimyasal ve fiziksel veriler | |
| Formül | C6428H9912N1694O1987S46 |
| Mol kütlesi | Error in {{değer}}: parametre 1 geçerli bir sayı değil. g·mol−1 |
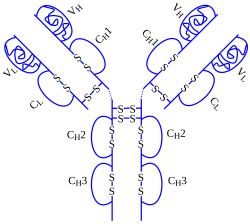
Adalimumab (ticari adı HUMIRA), infliksimab ve etanercept'ten sonra FDA onayını almış olan üçüncü TNF inhibitörüdür.[43] Tıpkı onlar gibi, adalimumab da TNFα'ya bağlanarak, onun kendi almaçlarına bağlanmasını önlemektedir; adalimumab tamamen insan monoklonal antikoru kullanılarak üretilmiştir, oysa infliksimab bir fare-insan chimeric antikorudur ve etanercept ise TNF almaç-IgG füzyon proteinidir. TNFα'ya bağlanarak sitokini inhibe eder ve böylece makrojların ve bazı T lenfosit hücrelerinin down-regülasyonunu sağlar, böylece immün yanıt düzenlenmiş olur.[44] 2008 itibarıyla adalimumab FDA tarafından Romatoid Artrit, Psoriatik Artrit, Ankilozan spondilit, Crohn hastalığı, orta ve ileri derecede ciddi Sedef hastalığı ve Juvenil İdyopatik Artrit tedavisi için onaylanmıştır. Humira (müstahzar adı "Human Monoclonal Antibody in Rheumatoid Arthritis" yani "Romatoid Artritte İnsan Monoklonal Antikoru"nun kısaltmasıdır) 0,8ml şırınga ya da Otoenjektör olarak satılmaktadır, her ikisi de subkutan olarak enjekte edilirler, genellikle hasta evinde kendisi bu işlemi yapar. Oral yolla kullanımı uygun değildir, çünkü sindirim sisteminde parçalanmaktadır. Yarı ömrü 10-20 gündür.
Humira'nın üreticisi Abbott Laboratories adlı firmadır.
Molekül DSÖ'nün Temel İlaçlar Listesi'nde yer almaktadır.
Kullanım Alanları
[değiştir | kaynağı değiştir]Adalimumab, diğer TNF inhibitörü rakipleri, infliximab ve etanercept gibi, birçok farklı koşulda etkili terapötik özelliklere sahiptir.
Romatoid Artrit
[değiştir | kaynağı değiştir]Adalimumab yetişkinlerde orta ya da ileri derecede ciddi Romatoid Artrit durumunda kullanıldığında hastalığın semtomlarını belirgin biçimde azaltmaktadır. Ayrıca 4 yaş ve üstü çocuklarda JIA (Juvenil Idyopatik Artrit) tedavisinde kullanımı da onaylanmıştır. RA'da tek başına ya da metotreksat ile birlikte kullanılabilir.
Psoriatik Artrit
[değiştir | kaynağı değiştir]Adalimumab tek başına ya da diğer ilaçlarla birlikte kullanıldığında Psoriatik Artrit semptomlarının azalmasını sağlamaktadır.
Ankilozan spondilit
[değiştir | kaynağı değiştir]Adalimumab yetişkinlerde Ankilozan spondilit tedavisinde etkili bir ilaçtır.
Crohn hastalığı
[değiştir | kaynağı değiştir]Adalimumab Crohn hastalığı semtomlarının düzelmesini sağlamaktadır.[45] Diğer ilaçlarla hatta infliksimab ile tedaviye yanıt vermeyen orta ve ileri derecede ciddi Crohn hastalığı tedavisinde onaylanmıştır.
Plak psoriasisi
[değiştir | kaynağı değiştir]Adalimumab, vücudunun birçok bölgesinde lezyonları olan, sistemik hap tedavisi ya da fototerapi alan orta ya da ileri derecede ciddî plak psoriasisi vakalarında endikedir.
Behçet Hastalığı
[değiştir | kaynağı değiştir]FDA ya da başka bir kuruluş tarafından lisanlandırılmış olmasa da, bazı araştırmalarda adalimumabın Behçet hastalığına karşı etkili olduğunu sonucuna varılmıştır.[46]
Güvenilirlik
[değiştir | kaynağı değiştir]Adalimumab bir immünsüpresif sınıfı ilaçtır ve bu yüzden ciddi güvenilirlik tartışmaları vardır, potansiyel fatal ajan olabilir. İlaç onaylandıktan sonra yapılan çalışmalarda tüberkülozu da kapsayan birçok bakteriyel, viral, fungal enfeksiyonların, ciddi hematolojik bozuklukların, nadiren de lenfoma ve solid doku tümörlerinin riskini artırdığı, nadiren ciddi karaciğer hasarı yaptığı, yine ender de olsa kalp yetmezliğini ve demyelinizan hastalıkları tetiklediği gösterilmiştir. Bunun üzerine Amerikan Gıda ve İlaç Dairesi FDA, ilaca bir kara kutu uyarısı eklemiş ve onların adalimumab tedavisindeki hastaları sık sık ve ciddi bir biçimde gözlemlemeleri gerektiğini söylemiştir. FDA'nın koyduğu etiket:[47]
Gebelik kategorisi B'dir.[48]
Tarihçe
[değiştir | kaynağı değiştir]- 1 Nisan 1995: Cambridge Antibody Technology Limited Knoll Aktiengesellschaft[49] ile anlaşma imzalar
- 2 Mart 2001: Abbott Laboratories Knoll Pharmaceuticals 'ı BASF'den satın alır.
- Haziran, 2001: ARMADA, çift-kör, plasebo-kontrollü, metotreksat tedavisine yanıt vermemiş 271 romatoid artrit hastasını kapsayan klinik deneme sonuçları açıklandı. Hastaların %50'si ACR skoru bakımından %50 ilerleme sağlamıştı.
- 31 Aralık 2002: Humira FDA tarafından onaylanmıştır.
Benzer etkili ajanlar
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- Katzung, Bertram G. Basic & Clinical Pharmacology. McGraw-Hill, 2018, pp 653–654.
- ^ a b "Idacio- adalimumab injection, solution". DailyMed. 22 Mart 2023. 11 Mart 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2024.
- ^ a b c "Yuflyma- adalimumab injection". DailyMed. 27 Mayıs 2023. 26 Haziran 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Haziran 2023.
- ^ a b "Hyrimoz: FDA-Approved Drugs". U.S. Food and Drug Administration (FDA). 30 Ekim 2018. 7 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Aralık 2019.
 Bu madde, bu kaynaktan alınan kamu malı olan bir metni içermektedir.
Bu madde, bu kaynaktan alınan kamu malı olan bir metni içermektedir.
- ^ "CYLTEZO- adalimumab-adbm kit". DailyMed. 12 Temmuz 2023. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ a b "Abrilada- adalimumab-afzb kit; Abrilada- adalimumab-afzb injection, solution". DailyMed. 26 Ocak 2024. 30 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mart 2024.
- ^ a b c "Yusimry- adalimumab-aqvh injection, solution". DailyMed. 31 Mart 2023. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ "Amjevita- adalimumab-atto injection". DailyMed. 11 Nisan 2023. 26 Haziran 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Haziran 2023.
- ^ a b c "Hadlima- adalimumab-bwwd solution". DailyMed. 11 Temmuz 2023. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ a b "Hulio- adalimumab kit". DailyMed. 9 Ağustos 2023. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ a b "Simlandi- adalimumab-ryvk kit". DailyMed. 23 Şubat 2024. 2 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Nisan 2024.
- ^ "Summary Basis of Decision (SBD) for Abrilada". Health Canada. 23 Ekim 2014. 29 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mayıs 2022.
- ^ "Amgevita EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 30 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Amsparity EPAR". European Medicines Agency (EMA). 9 Aralık 2019. 18 Şubat 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ a b c d "Ciptunec/Ardalicip APMDS". Therapeutic Goods Administration (TGA). 27 Eylül 2022. 30 Eylül 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2022.
- ^ "Cadila Pharmaceuticals launches Cadalimab (Adalimumab biosimilar) for India". Cadila Pharmaceuticals (Basın açıklaması). 28 Ağustos 2020. 30 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2023.
- ^ "Cyltezo EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 6 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "First biosimilar Humira launches in India". 17 Aralık 2014. 25 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Temmuz 2023.
- ^ "Halimatoz EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 30 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Hefiya EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 15 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Hukyndra EPAR". European Medicines Agency (EMA). 14 Eylül 2021. 24 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Nisan 2022.
- ^ "Hulio EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 24 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Hyrimoz EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 16 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Idacio EPAR". European Medicines Agency (EMA). 29 Ocak 2019. 30 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Imraldi EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 24 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Kromeya EPAR". European Medicines Agency (EMA). 29 Ocak 2019. 30 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Libmyris EPAR". European Medicines Agency (EMA). 14 Eylül 2021. 24 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Nisan 2022.
- ^ "Summary Basis of Decision (SBD) for Simlandi". Health Canada. 23 Ekim 2014. 29 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mayıs 2022.
- ^ "Solymbic EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 25 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Trudexa EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 18 Şubat 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2021.
- ^ "Yuflyma EPAR". European Medicines Agency (EMA). 9 Aralık 2020. 28 Ağustos 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Şubat 2021.
- ^ "Adalimumab Pregnancy and Breastfeeding Warnings". Drugs.com. 17 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Mart 2019.
- ^ a b "Yuflyma APMDS". Therapeutic Goods Administration (TGA). 8 Nisan 2022. 24 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Nisan 2022.
- ^ AusPAR: Adalimumab. Therapeutic Goods Administration (TGA). September 2020. 8 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ AusPAR: Adalimumab. Therapeutic Goods Administration (TGA). September 2020. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ AusPAR: Adalimumab. Therapeutic Goods Administration (TGA). September 2020. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ "AusPAR: Adalimumab". Therapeutic Goods Administration (TGA). 23 Eylül 2020. 27 Ekim 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Eylül 2020.
- ^ AusPAR: Adalimumab. Therapeutic Goods Administration (TGA). September 2020. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ AusPAR: Adalimumab. Therapeutic Goods Administration (TGA). September 2020. 6 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ekim 2023.
- ^ "Health product highlights 2021: Annexes of products approved in 2021". Health Canada. 3 Ağustos 2022. 25 Mart 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Mart 2024.
- ^ "Humira 40 mg solution for injection in pre-filled syringe - Summary of Product Characteristics (SmPC)". (emc). 27 Kasım 2019. 4 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ağustos 2020.
- ^ "Humira- adalimumab kit Humira- adalimumab injection, solution". DailyMed. 21 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020.
- ^ "Humira EPAR". European Medicines Agency (EMA). 17 Eylül 2018. 18 Şubat 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Şubat 2020. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ "Biyolojik Ajanlar" (PDF). 2014. 15 Temmuz 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ "Adalimumab" (PDF). TURKDERM. 2016. 21 Nisan 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ Podolsky, Daniel K. (Ağustos 2002). "Inflammatory bowel disease". New England Journal of Medicine. 346 (6). ss. 417-29. doi:10.1056/NEJMra020831. PMID 12167685. 5 Ocak 2010 tarihinde kaynağından arşivlendi2 Temmuz 2006.
- ^ Ishigatsubo, Yoshiaki; Ueda, Atsuhisa; Takeno, Mitsuhiro (Nisan 2015). "Adalimumab in the management of Behçet's disease". Therapeutics and Clinical Risk Management (İngilizce): 611. doi:10.2147/TCRM.S56163. ISSN 1178-203X. PMC 4403514
 . PMID 25926738. 30 Eylül 2020 tarihinde kaynağından arşivlendi22 Kasım 2020.
. PMID 25926738. 30 Eylül 2020 tarihinde kaynağından arşivlendi22 Kasım 2020.
- ^ "MEDICATION GUIDE HUMIRA® (Hu-MARE-ah) (adalimumab) injection, for subcutaneous use" (PDF). 13 Kasım 2008 tarihinde kaynağından (PDF) arşivlendi.
- ^ "Adalimumab (Humira)" (PDF). Türk Romatoloji Derneği. 14 Temmuz 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ [1] 21 Eylül 2013 tarihinde Archive.is sitesinde arşivlendi Cambridge Antibody Technology website
Dış bağlantılar
[değiştir | kaynağı değiştir]- HUMIRA Official site 2 Ocak 2021 tarihinde Wayback Machine sitesinde arşivlendi.
- myHUMIRA Official site 6 Şubat 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Google Timeline Search
