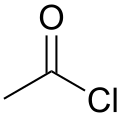
Asetil klorür
| |||

| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı Acetyl chloride[2] | |||
Ethanoyl chloride | |||
Diğer adlar Acyl chloride | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| 605303 | |||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.787 | ||
| EC Numarası |
| ||
| 1611 | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1717 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | CH 3COCl | ||
| Molekül kütlesi | 78.49 g/mol | ||
| Görünüm | Colorless liquid | ||
| Yoğunluk | 1.104 g/ml, liquid | ||
| Erime noktası | -112 °C (-170 °F; 161 K) | ||
| Kaynama noktası | 52 °C (126 °F; 325 K) | ||
| Çözünürlük (su içinde) | Reacts with water | ||
| −38.9·10−6 cm3/mol | |||
| Yapı | |||
| Dipol momenti | 2.45 D | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar |   
| ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H225, H302, H314, H335, H412 | ||
| Önlem ifadeleri | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P330, P363, P370+P378, P403+P233, P403+P235, P405, P501 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | 4 °C (39 °F; 277 K) | ||
| 390 °C (734 °F; 663 K) | |||
| Patlama sınırları | 7.3–19% | ||
| Benzeyen bileşikler | |||
Benzeyen acyl chlorides
|
Propionyl chloride Butyryl chloride | ||
Benzeyen bileşikler
|
Acetic acid Acetic anhydride Acetyl bromide | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Asetil klorür (CH
3COCl), asetik asitten türetilmiş asil klorür. Asit halojenürler adı verilen organik bileşik sınıfına aittir. Renksiz, aşındırıcı ve uçucu bir sıvıdır. Formülü genellikle AcCl olarak kısaltılır.
Asetil klorürün doğada bulunması beklenmez, çünkü suyla temas ettiğinde asetik asit ve hidrojen klorüre hidrolize olur. Açık havada kullanıldığında havadaki nemden kaynaklanan hidroliz sonucu beyaz bir "duman" açığa çıkarır. Duman aslında hidroliz sonucu oluşan küçük hidroklorik asit ve asetik asit damlacıklarıdır.
Üretimi
[değiştir | kaynağı değiştir]Endüstriyel ölçekte, asetik anhidritin hidrojen klorür ile reaksiyonu sonucunda asetil klorür ve asetik asit karışımı elde edilir:[3]
- (CH
3CO)
2O + HCl → CH
3COCl + CH
3CO
2H
Laboratuvar metodları
[değiştir | kaynağı değiştir]Asetil klorür ilk olarak 1852 yılında Fransız kimyager Charles Gerhardt tarafından potasyum asetatın fosforil klorür ile işlenmesiyle elde edilmiştir.[4]
Asetil klorür, laboratuvarda asetik asidin fosfor triklorür, fosfor pentaklorür, sülfüril klorür, fosgen veya tiyonil klorür gibi klorodehidratlayıcı maddelerle reaksiyonuyla üretilir.[5]
Isıtıldığında, dikloroasetil klorür ve asetik asit karışımı asetil klorür verir.[5] Ayrıca metil klorürün katalitik karbonilasyonundan da sentezlenebilir.[6]
Kullanımları
[değiştir | kaynağı değiştir]Asetil klorür, asetilasyon reaksiyonları, yani bir bileşiğe asetil grubunun eklenmesi için kullanılır. Asetil, −C(=O)−CH3 formülüne sahip bir asil grubudur. Asetilasyonun iki ana sınıfı esterleşme ve Friedel-Crafts reaksiyonudur.
Asetil klorür, alkol ve aminlerin türevlendirilmesinde kullanılan asetik asit ester ve amidlerinin hazırlanmasında kullanılan bir reaktiftir. Asetilasyon reaksiyonlarının bir sınıfı, etanol ile etil asetat ve hidrojen klorür üretmek için reaksiyona giren esterleşmedir:
- CH
3COCl + HO−CH
2−CH
3 → CH
3−COO−CH
2−CH
3 + HCl
Bu tür asilasyonlar genellikle piridin, trietilamin veya DMAP gibi bir bazın varlığında gerçekleştirilir. Bu bazlar, reaksiyonun ilerlemesine yardımcı olan ve bazlar olarak ortaya çıkan HCl'yi nötralize eden katalizör görevi görür. Bu tür reaksiyonlar genellikle keten yoluyla gerçekleşir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Merck Index, 11th Edition, 79.
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ss. 796-797. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045.
- ^
- Gerhardt, Charles (1852) "Ueber wasserfreie organische Säuren" (On anhydrous organic acids), Annalen der Chemie und Pharmacie, 83 : 112–116.
- Gerhardt, Charles (1853) "Untersuchungen über die wasserfreien organischen Säuren" (Investigations into anhydrous organic acids), Annalen der Chemie und Pharmacie, 87 : 57–84; see especially pp. 68–71.
- ^ a b Leo A. Paquette (2005). "Acetyl chloride". Handbook of Reagents for Organic Synthesis, Activating Agents and Protective Groups. John Wiley & Sons. s. 16. ISBN 978-0-471-97927-2.
- ^ US 4352761, Erpenbach, Heinz; Klaus Gehrmann & Winfried Lork et al., "Production of acetyl chloride", 1982-10-05 tarihinde yayımlandı, assigned to Hoechst AG