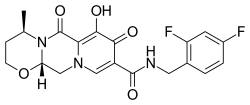
Dolutegravir
 | |
 | |
| Klinik verisi | |
|---|---|
| Ticari adlar | Tivicay, Tivicay PD |
| Diğer adlar | GSK572, S-349572 |
| AHFS/Drugs.com | Monografi |
| MedlinePlus | a613043 |
| Lisans veri |
|
| Gebelik kategorisi |
|
| Uygulama yolu | Ağızdan |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Biyoyararlanım | n/a[4] |
| Protein bağlanma | ≥%98,9 |
| Metabolizma | UGT1A1 ve CYP3A |
| Eliminasyon yarı ömrü | ~14 sa. |
| Boşaltım | Dışkı (%53) ve üre (%18,9) |
| Tanımlayıcılar | |
| |
| CAS Numarası | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB ligand | |
| CompTox Bilgi Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.237.735 |
| Kimyasal ve fiziksel veriler | |
| Formül | C20H19F2N3O5 |
| Mol kütlesi | 419,385 g·mol−1 |
| 3D model (JSmol) | |
| |
Dolutegravir (DTG), HIV/AIDS tedavisinde diğer ilaçlarla birlikte kullanılan bir antiretroviral ilaçtır.[6] Potansiyel maruziyeti takiben HIV enfeksiyonunu önlemek için temas sonrası profilaksinin bir parçası olarak da kullanılabilir.[7] Ağızdan alınır.[6]
Yaygın yan etkiler arasında uyku güçlüğü, yorgun hissetme, ishal, yüksek kan şekeri ve baş ağrısı yer alır.[7] Şiddetli yan etkiler, alerjik reaksiyonları ve karaciğer problemlerini içerebilir.[7] Hamilelik sırasında kullanımının bebeğe zarar verebileceğine dair kesin olmayan endişeler vardır.[7] Emzirme döneminde kullanımının güvenli olup olmadığı açık değildir.[7] Dolutegravir, viral replikasyon için gerekli olan HIV integrazın çalışmasını bloke eden bir HIV integraz sarmal transfer inhibitörüdür.[7]
Dolutegravir, 2013 yılında Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylanmıştır.[7] Dünya Sağlık Örgütü'nün Temel İlaçlar Listesi'nde yer almaktadır.[8] Abakavir/dolutegravir/lamivudin, abakavir ve lamivudin ile bir kombinasyon da mevcuttur.[7][9][10] 2019 itibarıyla, Dünya Sağlık Örgütü (WHO), HIV'li tüm kişiler için birinci ve ikinci basamak tedavi olarak DTG'yi önermektedir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ "Dolutegravir (Tivicay) Use During Pregnancy". Drugs.com. 16 Ekim 2018. 5 Nisan 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Şubat 2020.
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2014". Therapeutic Goods Administration (TGA). 21 Haziran 2022. 12 Ağustos 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Nisan 2023.
- ^ "Drug and medical device highlights 2018: Helping you maintain and improve your health". Health Canada. 14 Ekim 2020. Erişim tarihi: 17 Nisan 2024.
- ^ a b "Tivicay- dolutegravir sodium tablet, film coated". DailyMed. 24 Ekim 2019. Erişim tarihi: 13 Şubat 2020.
- ^ "Tivicay EPAR". European Medicines Agency (EMA). 17 Eylül 2018. Erişim tarihi: 13 Şubat 2020.
- ^ a b British national formulary : BNF 69. 69. British Medical Association. 2015. s. 429. ISBN 9780857111562.
- ^ a b c d e f g h "Dolutegravir Sodium Monograph for Professionals". Drugs.com (İngilizce). 21 Mart 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Nisan 2019.
- ^ World Health Organization model list of essential medicines: 21st list 2019. Cenevre: World Health Organization. 2019. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ "Dolutegravir plus lamivudine for the treatment of HIV-1 infection". Expert Review of Anti-infective Therapy. 18 (4): 279-292. April 2020. doi:10.1080/14787210.2020.1729742. PMID 32067525.
- ^ "HIV Treatment with the Two-Drug Regimen Dolutegravir Plus Lamivudine in Real-world Clinical Practice: A Systematic Literature Review". Infectious Diseases and Therapy. 10 (4): 2051-2070. August 2021. doi:10.1007/s40121-021-00522-7. PMC 8572911
 . PMID 34426899.
. PMID 34426899.
Dış bağlantılar
[değiştir | kaynağı değiştir]- "Dolutegravir". Drug Information Portal. U.S. National Library of Medicine. 23 Ocak 2017 tarihinde kaynağından arşivlendi.
