Bakır(II) sülfat
| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Bakır(II) sülfat | |||
Diğer adlar Küprik sülfat Mavi vitriyol (pentahidrat) Göztaşı (pentahidrat) Bonattit (trihidrat mineral) Boothit (heptahidrat mineral) Kalkantit (pentahidrat mineral) Kalkosiyanit (mineral) | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.952 | ||
| EC Numarası |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | CuSO4 | ||
| Molekül kütlesi | 159.62 g/mol (susuz) 249.70 g/mol (pentahidrat) | ||
| Görünüm | mavi (pentahidrat) grimsi beyaz (susuz) | ||
| Yoğunluk | 3.603 g/cm3 (susuz) 2.284 g/cm3 (pentahidrat) | ||
| Erime noktası | 110 °C (•4H2O) 150 °C (•5H2O) < 650 °C bozunur | ||
| Çözünürlük (su içinde) | pentahidrat 316 g/L (0 °C) 2033 g/L (100 °C) susuz 243 g/L (0 °C) 320 g/L (20 °C) 618 g/L (60 °C) 1140 g/L (100 °C) | ||
| Çözünürlük | susuz etanol de çözünmez pentahidrat metanol de çözünür 10.4 g/L (18 °C) etanol de çözünmez | ||
| Kırınım dizimi (nD) | 1.733 (susuz) 1.514 (pentahidrat) | ||
| Yapı | |||
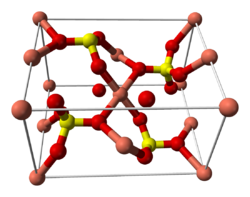
| Ortorombik (kalkosiyanit), space group Pnma, oP24, a = 0.839 nm, b = 0.669 nm, c = 0.483 nm[1] Triklinik (pentahidrat), space group P1, aP22, a = 0.5986 nm, b = 0.6141 nm, c = 1.0736 nm, α = 77.333°, β = 82.267°, γ = 72.567°[2] | |||
| Termokimya | |||
Standart molar entropi (S⦵298)
|
109.05 J K−1 mol−1 | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
−769.98 kJ/mol | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar |  
| ||
| R-ibareleri | R22, R36/38, R50/53 | ||
| G-ibareleri | S2, S22, S60, S61 | ||
| Tehlike ifadeleri | H302, H315, H319, H410 | ||
| Önlem ifadeleri | P273, P302+P352, P305+P351+P338 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | Tutuşmaz | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
300 mg/kg (oral, sıçan) 87 mg/kg (oral, fare) 470 mg/kg (oral, memeli hayvan) | ||
| AB İndeksi | 029-004-00-0 | ||
| AB sınıflandırması | Harmful (Xn) Irritant (Xi) Dangerous for the environment (N) | ||
| Güvenlik bilgi formu (SDS) | susuz pentahidrat | ||
| Benzeyen bileşikler | |||
Diğer katyonlar
|
Demir(II) sülfat Mangan(II) sülfat Nikel(II) sülfat Çinko sülfat | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Küprik sülfat ya da sadece bakır sülfat olarak da bilinen Bakır (II) sülfat, kimyasal formülü CuSO4 olan bir kimyasal bileşiktir. Bu tuzun hidrasyon derecelerine bağlı olarak bir dizi farklı bileşikleri mevcuttur. Susuz formu soluk yeşil ya da grimsi beyaz bir toz olmasına karşın en çok bilinen pentahidrat (CuSO4•5H2O) formu, parlak mavi renktedir. Çok az miktardaki CuSO4•5H2O çevreye çok zehirlidir, gözleri ve cildi tahriş eder ve yutulduğunda zararlı da olabilir. Oktahedral moleküler geometriye ve paramanyetik özelliğe sahip olan bakır (II) sülfat ekzotermik olarak suda çözünürek [Cu(H2O)6]2+ kompleksini oluşturur. Bakır (II) sülfat "mavi vitriyol", "göztaşı" ve "göktaşı" olarak da bilinmektedir.
Üretimi ve doğada bulunuşu
[değiştir | kaynağı değiştir]
Bakır sülfat'ın endüstriyel üretimi bakır oksitin sulandırılmış sülfürik asit ile
- CuO + H2SO4 → CuSO4 + H2O
- Veyahut,
bakır metalinin sıcak ve derişik sülfürik asit ile muamele edilmesi ile gerçekleştirilir.
- Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
Derişik sülfürik asit'in yükseltgen etkisinden kaçınmak ve verimlilik için, reaksiyon şartlarında değişikliğe gidilerek sulandırılmış sıcak sülfürik asit ve yükseltgen olarak da bol miktarda havanın reaksiyon ortamına verilmesi ile ticari üretim gerçekleştirilir.
- 2Cu + 2 H2SO4 + O2 → 2 CuSO4+ 2 H2O
Susuz formu kalkosiyanit olarak bilinen nadir bir mineral olarak doğada bulunur. Hidratlı bakır sülfat doğada kalkantit (pentahidrat) ve ondan daha az olarak da bonattit (trihidrat) ve boothit (heptahidrat) olarak bulunmaktadır.
Kimyasal özellikleri
[değiştir | kaynağı değiştir]Bakır (II) sülfat pentahidrat erimeden önce 150 °C'de bozunur, 63 °C'de iki su molekülünü, ardından 109 °C'de iki su molekülünü ve daha sonra da son su molekülünü de 200 °C'de kaybeder.[3][4]
Bakır (II) sülfat 650 °C'de, bakır(II) oksit (CuO) ve kükürt trioksite (SO3) bozunur.
- CuSO4 → CuO + SO3
Bakır sülfatın mavi rengi hidrasyon suyundan kaynaklanmaktadır. Kristaller alevde ısıtıldığında su kaybederek grimsi beyaz renge dönerler.[5]
Bakır sülfat çok derişik hidroklorik asit ile reaksiyona girer. Reaksiyonla, bakır (II) çözeltisinin mavi rengi tetraklorokuprat(II)'ın oluşmasından dolayı yeşil olur:
- Cu2+ + 4 Cl– → CuCl2-4
Ayrıca, bakırdan daha reaktif metallerle (örn. Mg, Fe, Zn, Al, Sn, Pb vb.) de reaksiyona girer:
- CuSO4 + Zn → ZnSO4 + Cu
- CuSO4 + Fe → FeSO4 + Cu
- CuSO4 + Mg → MgSO4 + Cu
- CuSO4 + Sn → SnSO4 + Cu
- 3 CuSO4 + 2 Al → Al2(SO4)3 + 3 Cu
Oluşan bakır diğer metalin yüzeyinde toplanır. Metalin tüm yüzeti bakırla kaplandığında, reaksiyon durur.
Kullanımı
[değiştir | kaynağı değiştir]Fungisit,herbisit ve pestisit olarak kullanımı
[değiştir | kaynağı değiştir]Bakır sülfat pentahidrat bir fungusittir.[6] Bununla birlikte, bazı funguslar yüksek düzeydeki bakır iyonlarına uyum sağlayabilir.[7] Kireç ile karıştırıldığında Bordo bulamacı, sodyum karbonat ile karıştırıldığında ise Burgonya bulamacı adı verilen ve özellikle bağlardaki ve meyve ağaçlarındaki mantari hastalıklarla mücadele amacıyla kullanılan zirai ilaçların hazırlanmasında kullanılır.[8] Bahçe bitkileri yetiştiriciliğinde fidelerdeki çökerten hastalığına karşı kullanılan bakır sülfat ve amonyum karbonat karışımı olan Cheshunt bileşimi, nin hazırlanması bir başka uygulama alanıdır. Tarım alanında olmasa bile, istilacı sucul bitkiler ve su borularının yakınındaki bitki köklerine karşı bir herbisit olarak da kullanılır. Yosun önleyici olarak yüzme havuzlarında kullanılmaktadır. Çoğu alg türü, bakır sülfatın çok düşük konstrasyonları ile kontrol edilebilir. Seyreltik bakır sülfat çözeltisi akvaryum balıklarındaki parazit enfeksiyonların tedavisinde [9] ve ayrıca akvaryumlardaki salyangozları öldürmek için kullanılır. Bakır iyonları balıklar için son derece zehirli olduğundan uygulama dozajına çok dikkat edilmelidir. Bakır sülfat Escherichia coli gibi bakterilerin büyümesini engeller.
Yirminci yüzyılda çoğunlukla, kromlu bakır arsenat (CCA) demiryolu traversi ve derin çakılmış temel kazığı, elektrik direği dışındaki kullanımlar için ahşap korumada hakim oldu. Emprenye yapmak için, kimyasal bir banyo çözeltisi büyük bir silindir kaba doldurulur. Kereste silindir kap içine konmadan önce bakır sülfat pentahidrat diğer katkı maddeleri ile birlikte suda eritilir. Silindir kap, kapatılıp içine basınç uygulandığında, kimyasal maddeler ahşap tarafından emilerek ahşaba mantar, böcek ve UV-ışık etkenlerine karşı korunmasına yardımcı olacak özellik kazandırır.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Kokkoros, P. A.; Rentzeperis, P. J. (1958). "The crystal structure of the anhydrous sulphates of copper and zinc". Acta Crystallographica. 11 (5). ss. 361-364. doi:10.1107/S0365110X58000955.
- ^ Bacon, G. E.; Titterton, D. H. (1975). "Neutron-diffraction studies of CuSO4 • 5H2O and CuSO4 • 5D2O". Z. Kristallogr. 141 (5–6). ss. 330-341. doi:10.1524/zkri.1975.141.5-6.330.
- ^ Andrew Knox Galwey; Michael E. Brown (1999). Thermal decomposition of ionic solids. Elsevier. ss. 228-229. ISBN 0-444-82437-5. 29 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2012.
- ^ Wiberg, Egon (2001). Inorganic chemistry. Academic Press. s. 1263. ISBN 0-12-352651-5. 29 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2012.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Johnson, George Fiske (1935). "The Early History of Copper Fungicides". Agricultural History. 9 (2). ss. 67-79. JSTOR 3739659.
- ^ Parry, K. E.; Wood, R. K. S. (1958). "The adaption of fungi to fungicides: Adaption to copper and mercury salts". Annals of Applied Biology. 46 (3). s. 446. doi:10.1111/j.1744-7348.1958.tb02225.x.
- ^ "Uses of Copper Compounds: Copper Sulfate's Role in Agriculture". Copper.org. 7 Eylül 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Aralık 2007.
- ^ "All About Copper Sulfate". National Fish Pharmaceuticals. 10 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Aralık 2007.