Boraks

| |
| |
| Adlandırmalar | |
|---|---|
Diğer adlar
| |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Numarası | |
| E numaraları | E285 (koruyucular) |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Kimyasal formül | H20B4Na2O17 |
| Molekül kütlesi | 381,37 g mol−1 |
| Görünüm | White or colorless crystalline solid |
| Yoğunluk | 1.73 g/cm3 (decahydrate, solid)[2] |
| Erime noktası | 743 °C (1.369 °F; 1.016 K) (anhydrous)[2] 75 °C (decahydrate, decomposes)[2] |
| Kaynama noktası | 1.575 °C (2.867 °F; 1.848 K) (anhydrous)[2] |
| Çözünürlük (su içinde) | 31.7 g/L [2] |
| −85.0·10−6 cm3/mol (anhydrous)[2]:p.4.135 | |
| Kırınım dizimi (nD) | n1=1.447, n2=1.469, n3=1.472 (decahydrate)[2]:p.4.139 |
| Yapı[3] | |
| Monoklinik, mS92, No. 15 | |
| C2/c | |
| 2/m | |
a = 1.1885 nm, b = 1.0654 nm, c = 1.2206 nm α = 90°, β = 106.623°°, γ = 90°
| |
Kafes hacmi (V)
|
1.4810 nm3 |
Formül birimleri (Z)
|
4 |
| Farmakoloji | |
| S01AX07 (DSÖ) | |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| Tehlike ifadeleri | H360 |
| Önlem ifadeleri | P201, P308+P313 |
| NFPA 704 (yangın karosu) |
|
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | none[4] |
| REL (tavsiye edilen) | TWA 1 mg/m3 (anhydrous and pentahydrate)[4][5] TWA 5 mg/m3 (decahydrate)[6] |
| IDLH (anında tehlike) | N.D.[4] |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Sodyum alüminat |
Diğer katyonlar
|
Lityum tetraborat |
Benzeyen bileşikler
|
Borik asit, sodyum perborat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
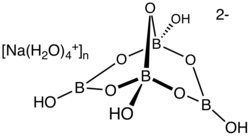
Boraks (sodyum borat, tinkâl ve tenkâr olarak da anılır), kimyasal formülü Na
2H
20B
4O
17 olan hidratlanmış veya susuz bir sodyum borat olan tuzdur (iyonik bileşik).[1] Suda çözündüğünde bazik bir çözelti oluşturan renksiz kristal yapıda bir katıdır.
Yaygın olarak toz veya granül formda bulunur ve pestisit, metal lehim pastası, cam, emaye ve çanak çömlek sırlarının bileşeni, derinin tabaklanması ve suni yaşlandırma dahil olmak üzere birçok endüstriyel ve evsel kullanıma alanına sahiptir. Ahşap mantarına karşı koruyucu olarak ve farmasötik bir alkalileştirici olarak kullanılmaktadır.[1][8] Kimya laboratuvarlarında tamponlama maddesi olarak kullanılır.
Tinkal ve tinkar terimi, tarihsel olarak Asya'nın çeşitli yerlerinde kuru göl yataklarından çıkarılan doğal boraks anlamına gelir.[9]
Tarih
[değiştir | kaynağı değiştir]Boraks ilk olarak Tibet'teki kuru göl yataklarında keşfedilmiştir. Tibet, İran ve Asya'nın diğer bölgelerinden gelen tinkal, MS 8. yüzyılda İpek Yolu üzerinden Arap Yarımadası'na ulaşmıştır.[9]
Boraks ilk olarak 19. yüzyılın sonlarında, Francis Marion Smith'in Pacific Coast Borax Company'nin, adını boraksın orijinal olarak çıkarıldığı yöntemden alan 20 Mule Team Borax ticari markası altında Kaliforniya ve Nevada çöllerinden çıkarılan boraksın çok çeşitli kullanımlarının pazarlamaya ve yaygınlaştırmaya başlamasıyla yaygın kullanıma girdi.[10][11]
Etimoloji
[değiştir | kaynağı değiştir]İngilizce borax kelimesi Orta İngilizce: boras, Eski Fransızca: boras, bourras kökeninden gelmektedir. Bunlar da Orta Çağ Latince: baurach (başka bir İngilizce yazım), borac(-/um/em), borax kelimelerinden köken almaktadır.[12][13]
Tincal ve tincar kelimeleri İngilizceye 17. yüzyılda Malayca: tingkal ve Urduca/Farsçadan تنکار tinkār/tankār kökenlerinden geçmiştir. Bunların hepsi Sanskrit: टांकण ṭānkaṇa ile ilgili görünmektedir.
Doğal Kaynaklar
[değiştir | kaynağı değiştir]
Boraks doğal olarak mevsimlik göllerin tekrarlayan buharlaşmasıyla oluşan evaporit yataklarında bulunur. Ticari açıdan en önemli yataklar şu ülkelerde bulunur: Türkiye ve Searles Gölü, Kaliforniya. Ayrıca, Güneybatı Amerika Birleşik Devletleri'ndeki diğer birçok yerde, Şili'deki Atacama çölünde, Bolivya'da ve Tibet ve Romanya'da yeni keşfedilen yataklarda boraks bulunmuştur. Boraks diğer bor bileşiklerinden sentetik olarak da üretilebilir.
Doğal olarak oluşan boraks (Amerika Birleşik Devletleri'nde ve diğer birçok ülkede Rasorite-46 ticari adıyla bilinir) yeniden kristalleştirme işlemiyle rafine edilir.[14]

Kullanımlar
[değiştir | kaynağı değiştir]
Boraks karıncalar için toksik olduğu için kontrol solüsyonlarında kullanılır. Yavaş etki gösterdiğinden işçi karıncalar boraksı yuvalarına taşır ve koloninin geri kalanını da zehirlerler.[15]
Boraks, 20 Mule Team Borax gibi çamaşır güçlendirici, Boraxo toz el sabunu ve bazı diş beyazlatma formülleri dahil olmak üzere çeşitli ev tipi çamaşır ve temizlik ürünlerinde kullanılır.[16][17][18][19]
Borat iyonları (genellikle borik asit olarak), biyokimya ve kimya laboratuvarlarında tampon yapmak için kullanılır. Bu amaçla DNA ve RNA'nın poliakrilamid jel elektroforezi için, TBE tamponu (borat tamponlu tris-hidroksimetilaminometonyum) veya Kaplama prosedürlerinde SB tamponu veya BBS tamponu (borat tamponlu salin) olarak kullanılmaktadır.[20][21] Borat tamponları (genellikle pH 8'de) ayrıca dimetil pimelimidat (DMP) bazlı çapraz bağlama reaksiyonlarında tercihli dengeleme çözeltileri olarak kullanılır.
Borat kaynağı olarak boraks çeşitli maddelerle kompleks iyonlar oluşturmak için boratın sudaki diğer maddelerle birlikte kompleks oluşturma yeteneğinden yararlanmak amacıyla kullanılmıştır.
Boraks, suyu yumuşatmak amacıyla kullanılmasına rağmen tek başına sertlik katyonları için yüksek bir afiniteye sahip değildir. Su yumuşatma için kimyasal denklemi aşağıda verilmiştir:
Katılan sodyum iyonları suyu "sert" yapmaz. Bu yöntem, hem geçici hem de kalıcı sertlik türlerinin giderilmesi için uygundur.
Demir ve çeliğin kaynağında eritken olarak boraks ve amonyum klorür karışımı kullanılır. İstenmeyen demir oksidin erime noktasını düşürerek akıp gitmesini sağlar. Boraks ayrıca erimiş lehimin metali ıslatmasına ve eklem içine eşit şekilde akmasına izin verdiği altın veya gümüş gibi takı metallerini lehimlerken bir akışkan olarak su ile karıştırılarak kullanılır. Boraks aynı zamanda tungsteni yumuşak lehimlenebilir hale getirmek için kullanılır.[22] Boraks genellikle dövme kaynağı için toz olarak kullanılır.
Zanaatkar altın madenciliğinde bazen, doğrudan cıvanın yerini alamamasına rağmen, altın çıkarma işleminde toksik cıva ihtiyacını ortadan kaldırmayı amaçlayan boraks yöntemi (bir akış olarak) olarak bilinen bir işlemin parçası olarak kullanılır. Boraksın 1900'lerde Filipinler'in bazı bölgelerinde altın madencileri tarafından kullanıldığı bildirilmiştir.[23][24] Çevresel etkiyi azaltmanın yanı sıra, bu yöntemin uygun cevherler için daha iyi altın kazanımı sağladığına ve daha ucuz olduğuna dair kanıtlar mevcuttur. Bu boraks yöntemi Filipinler'in kuzeyindeki Luzon'da kullanılır. Yöntem ayrıca Bolivya ve Tanzanya'da da desteklenmiştir.[25][26]
Diğer kullanımlar:
- Emaye sırlarında [27]
- Cam, çömlek ve seramik bileşeni [28]
- Islak, yeşil eşya ve bisque üzerine uyumu iyileştirmek için seramik astarlarda ve sırlarda katkı maddesi olarak
- Yangıngeciktirici [29]
- Selüloz yalıtımı için mantar önleyici
- Yün için güve koruma solüsyonu
- İnatçı haşerelerin önlenmesi için toz (örn. Alman hamamböcekleri) dolaplarda, boru ve kablo girişlerinde, duvar kaplama boşluklarında ve sıradan pestisitlerin istenmediği erişilemeyen yerlerde kullanılır.
- Deterjanlarda kullanılan sodyum perborat monohidratın yanı sıra borik asit ve diğer boratların öncüsü
- Kazein, nişasta ve dekstrin bazlı yapıştırıcılarda yapışkanlaştırıcı bileşen
- Polivinil asetat, polivinil alkol bazlı yapıştırıcılarda yapışkanlaştırıcı bileşen olan borik asit öncüsü
- Şellak'ı ısıtılmış boraksta eriterek daldırma kalemler için silinmez mürekkep yapmak için
- Yılan derileri için kürleme maddesi
- Somon balığı balıkçılığında kullanım amacıyla somon yumurtaları için kürleme maddesi
- pH'ı kontrol etmek için yüzme havuzu tamponlama maddesi
- Nötron soğurucu, reaktiviteyi kontrol etmek ve bir nükleer zincir reaksiyonunu durdurmak için nükleer reaktörlerde ve kullanılmış yakıt havuzlarında kullanılır.
- Bor eksikliği olan toprakları düzeltmek için bir mikro besin gübresi olarak
- Tahnitçilikte koruyucu
- Alevleri yeşil bir tonla renklendirmek için
- Geleneksel olarak görünümü iyileştirmek ve sinekleri kovmak amacıyla jambon gibi kuru etleri kaplamak için kullanılır
- Dövme kaynağında demirciler tarafından kullanılır
- Safsızlıkları çıkarmak ve oksidasyonu önlemek için dökümde metalleri ve alaşımları eritmek için eritici olarak kullanılır
- Parçacık fiziğinde, yüklü parçacık izlerinin gizli görüntü ömrünü uzatmak için nükleer emülsiyona bir katkı maddesi olarak. 1950 Nobel Ödülü'ne layık görülen pion'un ilk gözleminde bu tür bir emülsiyon kullanıldı.
Toksisite
[değiştir | kaynağı değiştir]Bir araştırmaya göre boraks akut olarak toksik değildir. LD50 (medyan öldürücü doz) skoru farelerde 2,66 g/kg olarak tespit edilmiştir, bu da ciddi semptomlara veya ölüme neden olmak için kimyasalın önemli bir dozunun gerekli olduğu anlamına gelir. Ölümcül doz insanlar için aynı değildir. Pestisit bilgi web sitelerinde öldürücü olmayan bir bileşik olarak listelenir.
Boraks, 1946'dan beri Amerika Birleşik Devletleri'nde çeşitli kısıtlamalarla böcek ilacı olarak kullanılmaktadır. Borik asit ve boraks ile ilgili iki EPA belgesinde belirtildiği gibi boraksın düşük toksisitesi nedeniyle tüm kısıtlamalar Şubat 1986'da kaldırılmıştır.
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d PubChem. "Borax". pubchem.ncbi.nlm.nih.gov (İngilizce). 27 Aralık 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Aralık 2021.
- ^ a b c d e f g Haynes, William M., (Ed.) (2011). CRC Handbook of Chemistry and Physics. 92nd. CRC Press. ISBN 978-1439855119.
- ^ Levy, H. A.; Lisensky, G. C. (1978). "Crystal structures of sodium sulfate decahydrate (Glauber's salt) and sodium tetraborate decahydrate (borax). Redetermination by neutron diffraction". Acta Crystallographica Section B. 34 (12). ss. 3502-3510. doi:10.1107/S0567740878011504
 .
.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0057". Ulusal İş Güvenliği ve Sağlığı Enstitüsü (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0059". Ulusal İş Güvenliği ve Sağlığı Enstitüsü (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0058". Ulusal İş Güvenliği ve Sağlığı Enstitüsü (NIOSH).
- ^ "Potential Commodities NFPA 704" (PDF). 17 Mayıs 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 9 Aralık 2018.
- ^ "CompTox Chemicals Dashboard". comptox.epa.gov. 1 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ocak 2022.
- ^ a b "Borax (Na2B4O7·10H2O ) – Sodium Borate – Occurrence, Discovery and Applications". Amoz.com. 16 Ağustos 2004. 21 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ "American Borax Production" Scientific American September 22, 1877
- ^ Hildebrand, G. H. (1982) "Borax Pioneer: Francis Marion Smith." San Diego: Howell-North Books. p. 267 0-8310-7148-6
- ^ "Tincal." Oxford Dictionary of English 2e, Oxford University Press, 2003.
- ^ Chemical Age of India, Vol. 37, No.10 & 11 (1976)
- ^ Wizniak, Jaime (July 2005). "Borax, Boric Acid, and Boron – From exotic to commodity" (PDF). Indian Journal of Chemical Technology. 12 (4). ISSN 0975-0991. 13 Mayıs 2022 tarihinde kaynağından arşivlendi (PDF)21 Mart 2023.
- ^ Klotz, John H.; Greenberg, Les; Amrhein, Christopher; Rust, Michael K. (1 Ağustos 2000). "Toxicity and Repellency of Borate-Sucrose Water Baits to Argentine Ants (Hymenoptera: Formicidae)". Journal of Economic Entomology. 93 (4). ss. 1256-1258. doi:10.1603/0022-0493-93.4.1256. PMID 10985039.
- ^ Sodium borate decahydrate (borax) in the Consumer Product Information Database
- ^ "The Many, Many Uses of Borax for Laundry". U.S. Borax. 30 Haziran 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2022.
- ^ Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 978-0-8493-0485-9.
- ^ O'Neil, M.J. (ed.). The Merck Index — An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 1595
- ^ Peacock, Andrew C.; Dingman, C. Wesley (1967). "Resolution of Multiple Ribonucleic Acid Species by Polyacrylamide Gel Electrophoresis". Biochemistry. 6 (6). ss. 1818-1827. doi:10.1021/bi00858a033. PMID 6035921.
- ^ Anderson, S. (1981). "Shotgun DNA sequencing using cloned DNase I-generated fragments". Nucleic Acids Research. 9 (13). ss. 3015-27. doi:10.1093/nar/9.13.3015. PMC 327328
 . PMID 6269069.
. PMID 6269069.
- ^ Dodd, J.G. (1966). "Soft soldering to tungsten wire". Am. J. Phys. 34 (10). ss. xvi. Bibcode:1966AmJPh..34D..16D. doi:10.1119/1.1972398.
- ^ "March 2012 ipad ewaste Filipino Borax, Pakistans Pollution, Artisanal Gold Mining". Blacksmithinstitute.org. 13 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ağustos 2016.
- ^ "The borax method" (PDF). Borax replacing mercury in small-scale mining. The Geological Survey of Denmark and Greenland (GEUS). 6 Aralık 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2 Ağustos 2008.
- ^ Appel, Peter W. U.; Andersen, Astrid; Na-Oy, Leoncio D.; Onos, Rudy (1 Aralık 2015). "Introduction of Mercury-free Gold Extraction Methods to Medium-Scale Miners and Education of Health Care Providers to Reduce the use of Mercury in Sorata, Bolivia". Journal of Health and Pollution. 5 (9). ss. 12-17. doi:10.5696/2156-9614-5-9.12. PMC 6221499
 . PMID 30524772.
. PMID 30524772.
- ^ Appel, Peter W.U.; Jønsson, Jesper Bosse (31 Aralık 1969). "Borax – an alternative to mercury for gold extraction by small-scale miners: introducing the method in Tanzania". Geological Survey of Denmark and Greenland (GEUS) Bulletin. Cilt 20. ss. 87-90. doi:10.34194/geusb.v20.4988
 .
.
- ^ "Alphabetical information on pottery glaze making materials and clay body ingredients". Sheffield Pottery. 4 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2019.
- ^ Schubert, David M. (2003). "Borates in Industrial Use". Roesky, Herbert W.; Atwood, David A. (Ed.). Group 13 Chemistry III. Group 13 Chemistry III: Industrial Applications. Structure and Bonding (İngilizce). 105. Springer Berlin Heidelberg. ss. 1-40. doi:10.1007/3-540-46110-8_1. ISBN 978-3-540-46110-4.
- ^ Shen, Kelvin K.; O’Connor, Roderick (1998), Pritchard, Geoffrey (Ed.), "Flame retardants: borates", Plastics Additives: An A-Z reference, Polymer Science and Technology Series (İngilizce), Springer Netherlands, ss. 268-276, doi:10.1007/978-94-011-5862-6_30, ISBN 978-94-011-5862-6
Dış bağlantılar
[değiştir | kaynağı değiştir]- National Pollutant Inventory – Boron and compounds
- NIOSH Pocket Guide to Chemical Hazards 21 Mart 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- Sodium Borate in sefsc.noaa.gov

